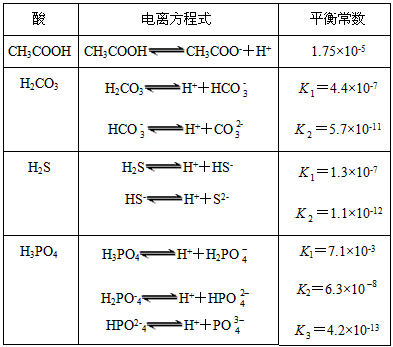
在化学领域,电离平衡常数是一种重要的物理量,它反映了弱电解质电离程度的大小。对于多元弱酸来说,它们在溶液中会分步电离,每一步的电离平衡常数都会有所不同。因此,利用电离平衡常数,我们可以研究多元弱酸的电离过程。
假设我们有一种多元弱酸H3PO4,它在溶液中可以分步电离成H2PO4-、HPO42-和PO43-。我们可以利用已知的电离平衡常数来计算各步电离的程度。
我们需要知道各步电离的平衡常数。这些平衡常数可以通过实验测定,也可以从文献中查找。例如,磷酸的一级电离平衡常数(K1)为7.1×10-3,二级电离平衡常数(K2)为6.3×10-8,三级电离平衡常数(K3)为4.4×10-13。
接下来,我们假设H3PO4的初始浓度为0.01mol/L。我们可以根据电离平衡常数和H3PO4的初始浓度来计算各步电离后的浓度。


[H2PO4-] = (K1 × [H3PO4])^0.5 = (7.1×10-3 × 0.01)^0.5 = 7.1×10-4^0.5 =
2.7×10-2mol/L

2.7×10-2mol/L,我们可以计算出第二步电离后HPO42-的浓度为:
[HPO42-] = (K2 × [H2PO4-])^0.5 = (6.3×10-8 ×
2.7×10-2)^0.5 = 1.8×10-3mol/L


[PO43-] = (K3 × [HPO42-])^0.5 = (4.4×10-13 × 1.8×10-3)^0.5 = 6.9×10-5mol/L
2.7×10-2mol/L,第二步电离后HPO42-的浓度为1.8×10-3mol/L,第三步电离后PO43-的浓度为6.9×10-5mol/L。这些数据表明,在磷酸分步电离的过程中,第一步和第二步电离的程度较大,而第三步电离的程度较小。